 |
Techniques de préparation d’échantillons pour la microscopie électronique |

|
Cette page rassemble l’ensemble des ressources qui utilisent les techniques de préparation d’échantillons à basse température pour une meilleure conservation morphologique. Les échantillons ainsi préparés pourront être observés en cryo-microscopie en transmission (MET) ou à balayage (MEB).
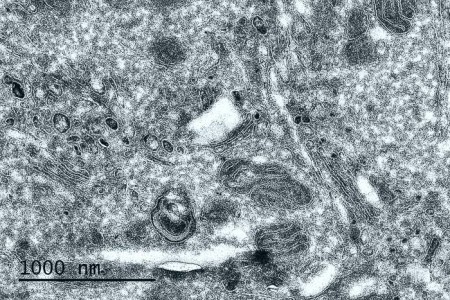
Cryosection de cellules tumorales fixées chimiquement (technique Tokuyasu) – Observation à 80KV
Services :
- Congélation ultra rapide par immersion dans l’éthane liquide ou par haute pression d’échantillons entiers (bactéries, virus, particules, liposomes, …) dans de la glace vitreuse jusqu’à 200µm d’épaisseur
- Cryo-sections (techniques CEMOVIS et Tokuyasu)
- Cryo-substitution et enrobage en résine automatisés à très basse température
- Cryo-fracture et sublimation
- Cryo-microscopie en transmission et à balayage
Mode d’accès :
- Assistance
- Prestation de service
Ressources en préparation d’échantillons pour microscopie électronique
Nom |
Caractéristiques techniques |
Lieu |
| Cryo-ultramicrotome Leica UC7/FC7 |
Chambre cryo amovible, cryosphère (évite la contamination par du givre), système antistatique & micromanipulateur | METi – Campus UPS |
| Cryosubstituteur AFS-2/FSP |
Automatisation complète des process, associé à un automate de gestion des réactifs | METi – Campus UPS |
| Cryofixateur haute pression Leica EM ICE |
Congélation de -8000 à -12000°/s sous une pression de 2000 bars | METi – Campus UPS |
| Cryoplunge Leica EMGP |
Automate de congélation ultra-rapide dans l’éthane, équipé stéréo-microscope | METi – Campus UPS |
| Module de cryopréparation PP3000T Quorum |
Chambre de cryo tranfert MEB FEG Quanta 250 FEI pour métallisation, cryo-fracture et sublimation |
CMEAB, Faculté de Médecine Rangueil |
 Quelques publications réalisées avec le concours de ces ressources :
Quelques publications réalisées avec le concours de ces ressources :
- Bidimensional lamellar assembly by coordination of peptidic homopolymers to platinum nanoparticles. Nat Commun., 11(1):2051. Manai G., Houimel H., Rigoulet M., Gillet A., Fazzini PF., Ibarra A., Balor S., Roblin P., Esvan J., Coppel Y., Chaudret B., Bonduelle C., Tricard S. (2020)
- Good Vibrations: Structural Remodeling of Maturing Yeast Pre-40S Ribosomal Particles Followed by Cryo-Electron Microscopy. Molecules. 25(5):1125. Shayan R., Rinaldi D., Larburu N., Plassart L., Balor S., Bouyssié D., Lebaron S., Marcoux J., Gleizes PE., Plisson-Chastang C. (2020)
- Post-mitotic dynamics of pre-nucleolar bodies is driven by pre-rRNA processing. J. Cell Science Octobre 2012. Carron C, Balor S, Delavoie F, Plisson-Chastang C, Faubladier M, Gleizes PE, O’Donohue MF
- Cord factor (trehalose 6,6′-dimycolate) forms fully stable and non-permeable lipid bilayers required for a functional outer membrane. Biochim Biophys Acta. Sep. 2013. Rath P, Saurel O, Czaplicki G, Tropis M, Daffé M, Ghazi A, Demange P, Milon A.
- Artificial feeding of Varroa destructor through a chitosan membrane: a tool for studying the host-microparasite relationship. Tabart J1, Colin ME, Carayon JL, Tene N, Payre B, Vetillard A. Exp Appl Acarol, 2013,61(1), 107-18.


